Asam Basa
1. Teori Asam Basa
Asam dan basa adalah dua golongan zat kimia yang sangat umum ditemukan di sekitar kita. Sebagai contoh, cuka, asam sitrun, dan asam dalam lambung tergolong asam, sedangkan kapur sirih dan soda api tergolong basa. Asam dan basa memiliki sifat-sifat yang berbeda. Pada mulanya, asam dan basa dibedakan berdasarkan rasanya, di mana asam terasa masam sedangkan basa terasa pahit dan licin seperti sabun. Namun, secara umum zat-zat asam maupun basa bersifat korosif dan beracun — khususnya dalam bentuk larutan dengan kadar tinggi — sehingga sangat berbahaya jika diuji sifatnya dengan metode merasakannya.
- Arrhenius
Teori ini pertama kalinya dikemukakan pada tahun 1884 oleh Svante August Arrhenius. Menurut Arrhenius, definisi dari asam dan basa, yaitu:
- asam adalah senyawa yang jika dilarutkan dalam air melepaskan ion H+.
- basa adalah senyawa yang jika dilarutkan dalam air melepaskan ion OH−.
Gas asam klorida (HCl) yang sangat larut dalam air tergolong asam Arrhenius, sebagaimana HCl dapat terurai menjadi ion H+dan Cl− di dalam air. Berbeda halnya dengan metana (CH4) yang bukan asam Arrhenius karena tidak dapat menghasilkan ion H+ dalam air meskipun memiliki atom H. Natrium hidroksida (NaOH) termasuk basa Arrhenius, sebagaimana NaOH merupakan senyawa ionik yang terdisosiasi menjadi ion Na+ dan OH− ketika dilarutkan dalam air. Konsep asam dan basa Arrhenius ini terbatas pada kondisi air sebagai pelarut.
- Bronsted-Lowry
Pada tahun 1923, Johannes N. Brønsted dan Thomas M. Lowry secara terpisah mengajukan definisi asam dan basa yang lebih luas. Konsep yang diajukan tersebut didasarkan pada fakta bahwa reaksi asam–basa melibatkan transfer proton (ion H+) dari satu zat ke zat lainnya. Proses transfer proton ini selalu melibatkan asam sebagai pemberi/donor proton dan basa sebagai penerima/akseptor proton. Jadi, menurut definisi asam basa Brønsted–Lowry:
- asam adalah donor proton.
- basa adalah akseptor proton.
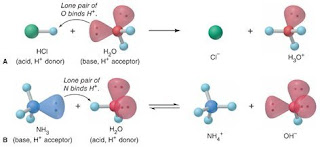
Jika ditinjau dengan teori Brønsted–Lowry, pada reaksi ionisasi HCl ketika dilarutkan dalam air, HCl berperan sebagai asam dan H2O sebagai basa.
HCl(aq) + H2O(l) → Cl−(aq) + H3O+(aq)
HCl berubah menjadi ion Cl− setelah memberikan proton (H+) kepada H2O. H2O menerima proton dengan menggunakan sepasang elektron bebas pada atom O untuk berikatan dengan H+ sehingga terbentuk ion hidronium (H3O+).
Sedangkan pada reaksi ionisasi NH3 ketika dilarutkan dalam air, NH3 berperan sebagai basa dan H2O sebagai asam.
NH3(aq) + H2O(l) ⇌ NH4+(aq) + OH−(aq)
NH3 menerima proton (H+) dari H2O dengan menggunakan sepasang elektron bebas pada atom N untuk berikatan dengan H+ sehingga terbentuk ion ammonium (NH4+). H2O berubah menjadi ion OH− setelah memberikan proton (H+) kepada NH3.
teori asam basa bronsted lowry
Pelarutan asam atau basa dalam air sebagai reaksi asam–basa Brønsted–Lowry (Sumber: Silberberg, Martin S. & Amateis, Patricia. 2015. Chemistry: The Molecular Nature of Matter and Change (7th edition). New York: McGraw-Hill Education)
Dari kedua contoh tersebut terlihat bahwa (1) asam Brønsted–Lowry harus mempunyai atom hidrogen yang dapat terlepas sebagai ion H+; dan (2) basa Brønsted–Lowry harus mempunyai pasangan elektron bebas yang dapat berikatan dengan ion H+.
Kelebihan definisi oleh Brønsted–Lowry dibanding definisi oleh Arrhenius adalah dapat menjelaskan reaksi-reaksi asam–basa dalam fase gas, padat, cair, larutan dengan pelarut selain air, ataupun campuran heterogen. Sebagai contoh, reaksi antara gas NH3 (basa) dan gas HCl (asam) membentuk asap NH4Cl.
NH3(g) + HCl(g) → NH4Cl(s)
Beberapa zat dapat bertindak sebagai asam, namun juga dapat sebagai basa pada reaksi yang lain, misalnya H2O, HCO3−, dan H2PO4−. Zat demikian disebut amfiprotik. Suatu zat amfiprotik (misalnya H2O) akan bertindak sebagai asam bila direaksikan dengan zat yang lebih basa darinya (misalnya NH3) dan bertindak sebagai basa bila direaksikan dengan zat yang lebih asam darinya (misalnya HCl).
- Lewis
Pada tahun 1923, G. N. Lewis mengemukakan teori asam basa yang lebih luas dibanding kedua teori sebelumnya dengan menekankan pada pasangan elektron yang berkaitan dengan struktur dan ikatan. Menurut definisi asam basa Lewis,
- asam adalah akseptor pasangan elektron.
- basa adalah donor pasangan elektron.
Berdasarkan definisi Lewis, asam yang berperan sebagai spesi penerima pasangan elektron tidak hanya H+. Senyawa yang memiliki orbital kosong pada kulit valensi seperti BF3 juga dapat berperan sebagai asam. Sebagai contoh, reaksi antara BF3 dan NH3 merupakan reaksi asam–basa, di mana BF3 sebagai asam Lewis dan NH3 sebagai basa Lewis. NH3 memberikan pasangan elektron kepada BF3 sehingga membentuk ikatan kovalen koordinasi antara keduanya.
Kelebihan definisi asam basa Lewis adalah dapat menjelaskan reaksi-reaksi asam–basa lain dalam fase padat, gas, dan medium pelarut selain air yang tidak melibatkan transfer proton. Misalnya, reaksi-reaksi antara oksida asam (misalnya CO2 dan SO2) dengan oksida basa (misalnya MgO dan CaO), reaksi-reaksi pembentukan ion kompleks seperti [Fe(CN)6]3−, [Al(H2O)6]3+, dan [Cu(NH3)4]2+, dan sebagian reaksi dalam kimia organik.