Ikatan kimia adalah sebuah proses fisika yang bertanggung jawab dalam interaksi gaya tarik menarik antara dua atom atau molekul yang menyebabkan suatu senyawa diatomik atau poliatomik menjadi stabil. Kekuatan ikatan-ikatan kimia sangatlah bervariasi. Pada umumnya, ikatan kovalen dan ikatan ion dianggap sebagai ikatan "kuat", sedangkan ikatan hidrogen dan ikatan van der Waals dianggap sebagai ikatan "lemah". Hal yang perlu diperhatikan adalah bahwa ikatan "lemah" yang paling kuat dapat lebih kuat daripada ikatan "kuat" yang paling lemah. Jari-jari atomik dan dionik. Jari-jari secara eksperimen merupakan separuh jarak antar inti atom. Jari-jari kovalen secara eksperimen mendefinisikan separuh jarak atom logam antara separuh jarak atom logam antara dua atom yang sama terkait secara bersama oleh ikatan kovalen. Jari-jari ionik berkaitan dengan jarak antara 2 inti yang terhubung oleh ikatan elektrosatatik antara anion dan kation masing-masing unsur.
Untuk menyusun pokok bahasan akan ditinjau 3 jenis utama dari ikatan:
1.Ikatan kovalen polar.
2.Ikatan kovalen nonpolar
3.Ikatan ion.
A. ikatan kovalen polar
ikatan kovalen memiliki keelektronegatifan yang sama besar, maka tidak akan mengakibatkan pengutuban atau polarisasi muatan. Hal ini kemudian dinamakan sebagain ikatan kovalen nonpolar.
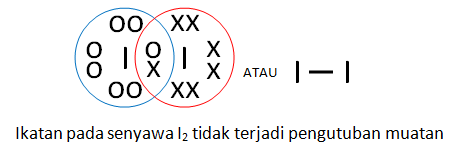
Contoh ikatan kovalen nonpolar: I2, Br2, H2, N2
Misalnya pada I2 dimana elektron digunakan oleh dua inti atom I. Oleh karena keelektronegatifannya sama besar, maka tidak terjadi pengutuban atau polarisasi. Perhatikan gambar di bawah ini.
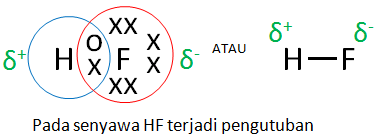
B. Ikatan kovalen polar
Sebuah senyawa terjadi ikatan kovalen polar apabila ada perbedaan kelektronegatifan yang mengakibatkan terjadinya pengutuban muatan. Misalnya pada senyawa HF dimana elektron bersamanya digunakan secara tidak seimbang oleh kedua inti atom H dan inti atom F.
Perhatikanlah gambar berikut ini.
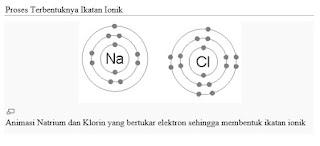
Ikatan ion terjadi akibat adanya serah terima elektron sehingga membentuk ion positif dan ion negatif yang konfigurasi elektronnya sama dengan gas mulia.
Contoh ikatan ion: NaCl
Faktor Geometri
Jari-jari dan kekuatan menarik elektron atom atau